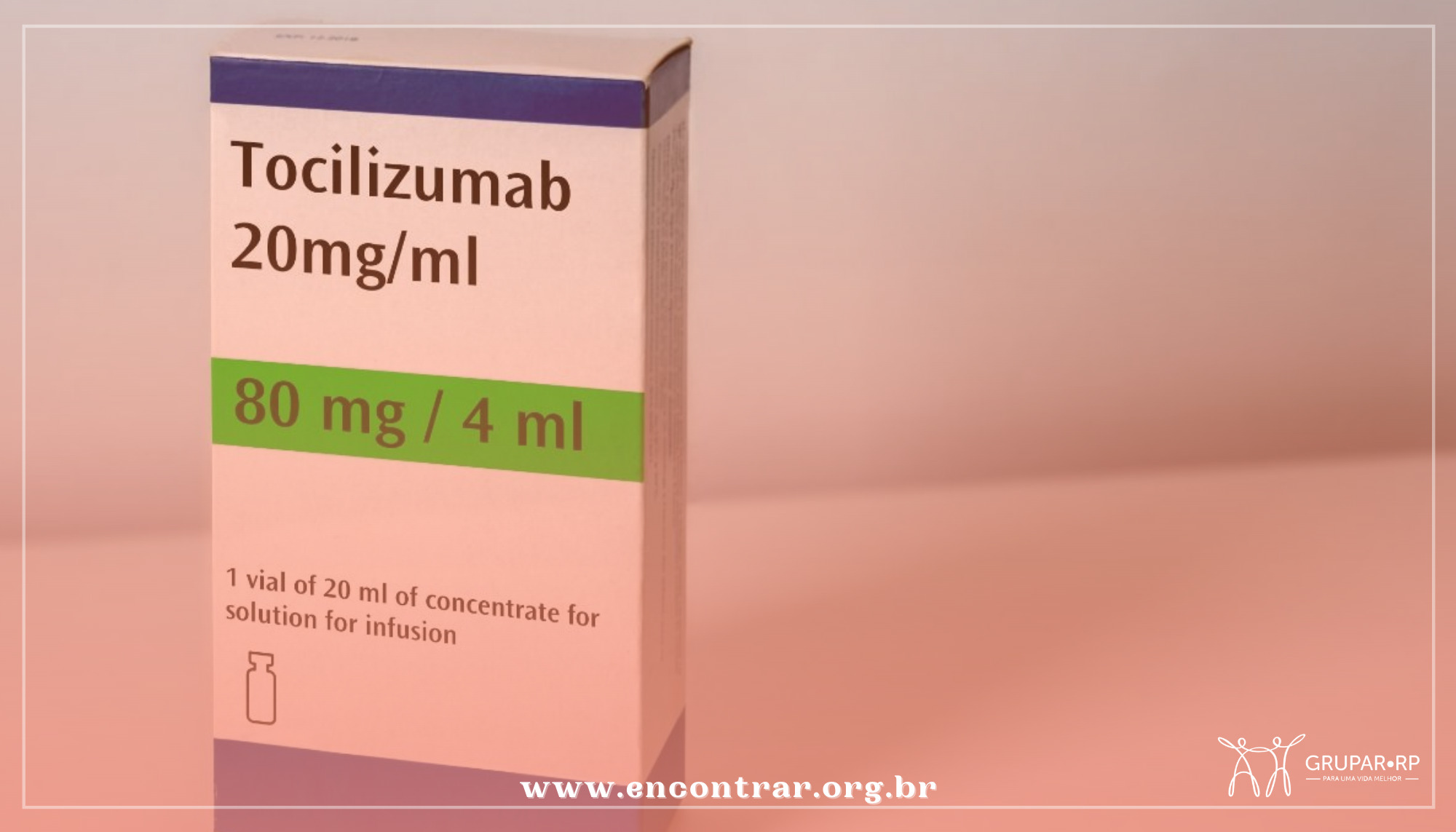
Diante de incertezas de abastecimento durante o remanejo do uso do medicamento tocilizumabe, normalmente utilizado para tratar artrite e outras doenças reumatológicas, para o tratamento da Covid-19, médicos estão sendo orientados a suspender, por ora, a prescrição do remédio para pacientes reumatológicos em remissão que estejam há pelo menos cinco anos com a doença não “ativa”.
A informação é da presidente da Sociedade Cearense de Reumatologia, a médica Niedja Bezerra Frota, a partir de uma manifestação da Sociedade Brasileira de Reumatologia (SBR).
“Foi orientado pela SBR que a gente suspendesse a medicação para pacientes em remissão em longo período e que não iniciasse novos tratamentos com o tocilizumabe. A preferência é para outras formas de tratamento. O uso, então, deve ser restrito para aquele paciente reumatológico que realmente não responde a outro tipo de medicação sem ser o tocilizumabe”, pontua Niedja. A presidente, no entanto, afirma que não há motivo para pânico, pois o abastecimento do remédio está garantido pelo SUS até, pelo menos, julho deste ano.
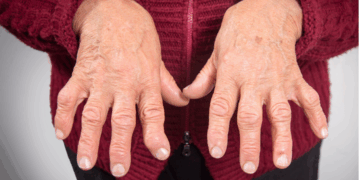
 Conforme a presidente, o tocilizumabe é utilizado para diminuir a inflamação em pacientes com artrite reumatoide, artrite infantil (artrite idiopática juvenil) e em outras doenças sistêmicas autoimunes. A interrupção do tratamento, que pode durar toda a vida do paciente, pode gerar retrocesso, segundo a SBR.
Conforme a presidente, o tocilizumabe é utilizado para diminuir a inflamação em pacientes com artrite reumatoide, artrite infantil (artrite idiopática juvenil) e em outras doenças sistêmicas autoimunes. A interrupção do tratamento, que pode durar toda a vida do paciente, pode gerar retrocesso, segundo a SBR.
Uso para Covid-19
Durante a pandemia, segundo a presidente Niedja, o tocilizumabe está sendo usado, de maneira off label (quando o direcionamento prescrito não está na bula), para diminuir a inflamação pulmonar causada pela Covid-19. No Ceará, nos hospitais da rede da Secretaria Estadual de Saúde (Sesa), a prescrição do medicamento não está no protocolo de tratamento da Covid-19, pois, assim como outros medicamentos, “ainda não possuem benefícios claros e não estão recomendados no nosso protocolo. Assim, seu uso deve estar indicado apenas no contexto de ensaios clínicos”.
Nas redes de saúde particular, segundo a presidente Niedja, o uso da medicação voltada para Covid-19 tem sido aplicada.
“Nós estamos vivendo uma pandemia em que todo mundo está em busca de uma alternativa de tratamento que surta efeito. Na ânsia de procurar, viu-se que a inibição da interleucina 6, presente no inflamatório em atividade, estava bem alta. A partir disso, tentou-se a possibilidade do Tocilizumabe. O uso tem sido off label, mas percebeu-se que alguns pacientes da covid-19 tinham resposta positiva. A partir de então, a demanda [da medicação] tem sido maior do que a oferta”, coloca a presidente.
A situação descrita se difere do uso da cloroquina, por exemplo, pois esta medicação também é não recomendada para Covid-19.
Em março deste ano, no entanto, a farmacêutica Roche, responsável pela comercialização do Actemra® (tocilizumabe) divulgou uma nota e mencionou que “atende integralmente a legislação brasileira e não realiza, nem apoia nenhuma ação de promoção do uso de Actemra® (tocilizumabe) para indicações não aprovadas em texto de bula”.
Também destacou que o uso off label de qualquer me/dicamento é faculdade exclusiva do médico prescritor, de acordo com termos do Código de Ética Médica.
Por nota, a Unimed Fortaleza informou que faz uso do Tocilizumabe no Hospital Unimed e que o medicamento é utilizado, prioritariamente, no tratamento de pacientes reumatológicos crônicos. A medicação também é administrada de maneira off label (conforme prescrição médica e assinatura de termo de consentimento) para alguns pacientes de Covid-19, “quando há sobra da medicação”.
“Apesar da dificuldade do abastecimento do medicamento no mercado, a cooperativa tem conseguido adquirir a quantidade necessária para garantir o tratamento dos pacientes reumatológicos”, aponta a nota.
Compra Autorizada
Segundo a Roche, o aumento da demanda e a consequente possível falta de algumas apresentações de tocilizumabe, foi comunicado à Agência Nacional de Vigilância Sanitária (ANVISA) em dezembro de 2020 e novamente em março de 2021.
De acordo com a médica Niedja, a SBR pediu à Anvisa a autorização para comercialização excepcional do medicamento com embalagem contendo informações em idioma e nome comercial (Roactemra), vindo dos Estados Unidos. O pedido foi aprovado na última terça (27).
O Diário do Nordeste entrou em contato com o Ministério da Saúde para saber mais detalhes sobre abastecimento e uso da medicação contra a Covid-19, mas a pasta federal não respondeu até o fechamento desta matéria.