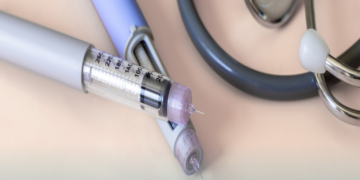
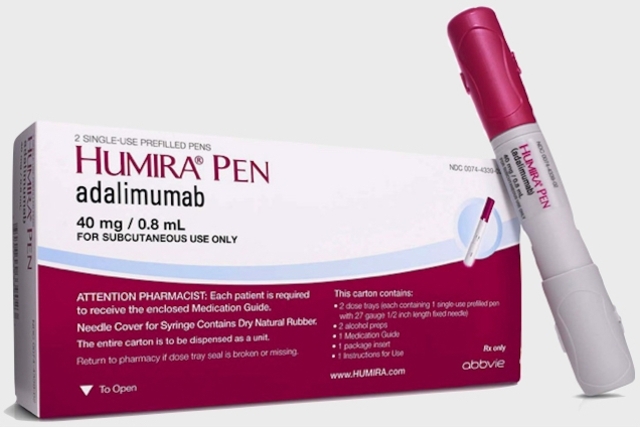
A AbbVie, companhia biofarmacêutica global dedicada à pesquisa e desenvolvimento, informa que o Sistema Único de Saúde (SUS) passa a disponibilizar HUMIRA® AC, formulação desenvolvida para reduzir a dor no local em que é aplicado. A nova formulação mantém o mesmo princípio ativo adalimumabe.
A AbbVie retirou o citrato, entre outros componentes da fórmula, reduzindo o volume da injeção pela metade e diminuindo o desconforto do paciente durante a aplicação da injeção. Não há alteração na concentração terapêutica de adalimumabe.
Dois estudos clínicos com pacientes com artrite reumatoide indicaram que a dor que se manifesta imediatamente após a aplicação, foi reduzida em média 84 por cento com Humira AC em relação à formulação anterior de Humira. Nesses estudos clínicos, cada um com 60 adultos com artrite reumatoide moderada a grave, os pacientes foram divididos em dois grupos, de forma randomizada – um grupo recebeu dose única de Humira ou de Humira AC, alternando na dose seguinte.
“Temos um compromisso de continuamente buscar a inovação em ciência tanto em medicamentos como também novas tecnologias, plataformas e dispositivos que possam trazer benefícios para os pacientes”, afirma Karina Fontão, diretora médica da AbbVie no Brasil.
No Brasil, HUMIRA está aprovado e é distribuído gratuitamente pelo SUS, sob prescrição médica, para o tratamento de Artrite Reumatoide, Artrite Idiopática Juvenil, Artrite Psoríasica, Doença de Crohn, Doença de Crohn pediátrica, Espondilite Anquilosante, Espondililoartrites, Hidradenite Supurativa, Retocolite Ulcerativa, artrite relacionada à entesite, Psoríase e Uveíte não infecciosa intermediária, posterior ou pan-uveíte e uveíte pediátrica.
Referência:
- Nash P, Vanhoof J, Hall S, et al. Randomized Crossover Comparison of Injection Site Pain with 40mg/0.4 or 0.8 mL. Formulations of Adalimumab in Patients with Rheumatoid Arthritis. Rheumatol Ther 2016; 3(2):257-270
Fonte: ABBVIE