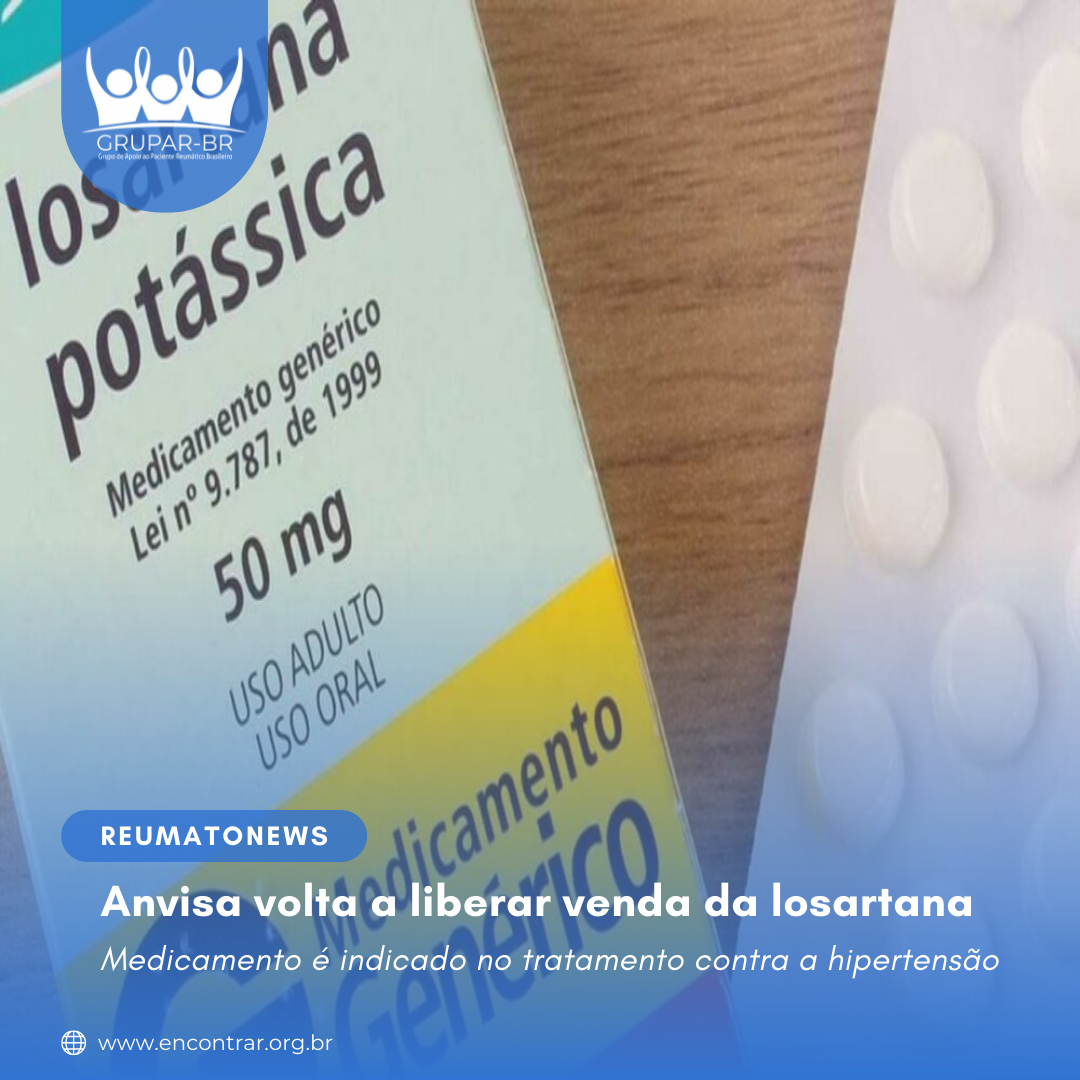
A Anvisa voltou atrás e anunciou na noite desta terça-feira, dia 12, a liberação da venda de medicamentos com a losartana como princípio ativo. A agência havia determinado o recolhimento do produto no início do junho, afetando boa parte das indústrias farmacêuticas em atuação no país.
A medida havia sido adotada em função da presença da impureza “azido” em concentração acima do limite de segurança aceitável, o que contemplou tanto medicamentos prescritos como as versões genéricas. No entanto, um diagnóstico da European Medicines Agency (EMA) abriu caminho para reverter a decisão.
No último dia 7, a pedido da Anvisa, a agência regulatória europeia apresentou estudos científicos que reclassificou o azido como uma substância não mutagênica. Isso significa que ela não apresenta a toxicidade inicialmente identificada.
Em comunicado ao mercado, a Anvisa informou que o recolhimento foi preventivo e que, “com os novos dados apresentados, os limites de segurança foram recalculados, indicando que os lotes do medicamento que foram recolhidos ou interditados não os ultrapassam”.
Recolhimento do losartana gerou apreensão no setor
O recolhimento da losartana afetou boa parte das farmacêuticas que fabricam o medicamento. A lista incluiu Aché, Biolab, Brainfarma, Cimed, Eurofarma, Geolab, Prati-Donaduzzi e Teuto. A decisão causou apreensão em fabricantes, distribuidores e varejistas, além de provocar reações de entidades setoriais, que criticaram a agência por ignorar ponderações do segmento e atuou de forma precipitada, afetando o acesso de 25 milhões de pessoas ao tratamento contra a hipertensão.
Dados da IQVIA apontam que a molécula losartana correspondeu a 78% das prescrições médicas de anti-hipertensivos nos últimos 12 meses até abril. Com 192,7 milhões de unidades comercializadas, a losartana respondeu por 92,5% das vendas da categoria no mesmo período, com preço quatro vezes menor que a segunda colocada – a olmesortana meloxomida.
Medicamento continuou disponível para farmácias
Apesar da medida, algumas opções foram consideradas seguras e continuaram a ser disponibilizadas para as farmácias. Foi o caso da versão do anti-hipertensivo da Pharlab, que integra a divisão de genéricos do grupo francês Servier.
A Pharlab apresenta todos os lotes em conformidade com critérios de segurança, qualidade e eficiência estabelecidos pela Anvisa e pelos órgãos internacionais de saúde e vigilância sanitária. A indústria atende em torno de 79 mil farmácias, entre redes e PDVs independentes.
Fonte: Redação Panorama Farmacêutico