A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou[1] em 26 de março dois novos medicamentos para tratamento de psoríase em placas e artrite psoriática em adultos, o guselcumabe e o apremilaste. O guselcumabe é um medicamento biológico indicado para tratar psoríase em placas em estágios de moderados a graves. Já o apremilaste é um sintético que também trata psoríase crônica em placas em estágios de moderados a graves, mas é indicado para pacientes que não responderam a outras terapias sistêmicas ou fototerapia, ou que são intolerantes aos medicamentos tradicionais. Além disso, o apremilaste está indicado para o tratamento da artrite psoriática ativa naqueles que não tiveram boa resposta aos antirreumáticos.
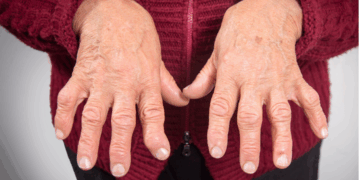
A psoríase em placas é o tipo mais comum da doença. Os outros são: ungueal, invertida, gutata, entre outros. O grau dela é calculado pelo Índice de Gravidade da Psoríase por Área (conhecido também pela sigla em inglês PASI, de Psoriasis Area Severity Index). De acordo com o Dr. Caio Castro, coordenador da Campanha Nacional de Psoríase da Sociedade Brasileira de Dermatologia (SBD), o critério usado para definir que a psoríase já saiu do grau leve é um escore acima de 10 no PASI. “Analisamos a quantidade de lesões e o tamanho delas. Mede-se desde o couro cabeludo até o pé, e fazemos o cálculo do PASI para definir se psoríase é leve, moderada ou grave”.
O cálculo pode ser feito com uma calculadora online (alternativa em inglês aqui). Para isso, divide-se o corpo em quatro partes: cabeça, tronco, membros superiores e membros inferiores e calcula-se a porcentagem de lesões em relação ao tamanho de cada uma dessas partes. Depois, é avaliada a intensidade de cada tipo de lesão, em uma escala de 0 a 4. São avaliados o eritema, a induração e a descamação.
“Quanto mais pontos ganhar de cada um dos itens, mais severa é a psoríase. Quanto maior a área, o eritema, a descamação, maior será o PASI que define a severidade da doença”, esclarece o Dr. Castro.
Guselcumabe
De acordo com o estudo publicado no Journal of the American Academy of Dermatology[2], o guselcumabe é um anticorpo monoclonal IgG1 humano que se liga seletivamente à citocina pró-inflamatória IL-23, agente central na imunopatogênese da psoríase. Ao se associar com a interleucina 23, o anticorpo em questão impede a ligação desta última ao seu receptor e, consequentemente, impede as sinalizações subsequentes. Com isso, o estudo concluiu que o medicamento é altamente efetivo e bem tolerado inclusive para pacientes que não respondem ao adalimumabe.
O Dr. Castro explica que, por mais que o medicamento seja indicado para tratamento das condições de moderadas a graves, ele também pode ser indicado para os pacientes que não responderam bem às medicações convencionais, como ciclosporina, acitretina e metotrexato, bem como à fototerapia.
“Um paciente que tem um problema hepático grave e não pode usar o metotrexato, por exemplo, tem como alternativa o medicamento biológico (guselcumabe). Ele atende àqueles que não tiveram boa resposta às medicações convencionais, têm intolerâncias ou contraindicações”, explica.
O especialista explica que, não fosse pelo custo, o guselcumabe seria o medicamento de escolha para o tratamento de psoríase. “Se fosse bem próximo ou apenas um pouco superior aos convencionais, sem dúvida o guselcumabe seria primeira-linha. Para o paciente, ele é muito melhor do que medicação oral diária, já que o guselcumabe é administrado por meio de injeções periódicas, tem resposta muito melhor e muito menos efeitos colaterais”.
A dose indicada é de 100 mg por via subcutânea na semana 0, na semana 4 e a cada oito semanas[3]. O guselcumabe é produzido pela farmacêuticaJanssen-Cilag, e está registrado com o nome de Tremfya.
Apremilaste
O apremilaste é um medicamento oral que se enquadra na classe dos inibidores da fosfodiesterase 4 (PDE4). A PDE4 é uma enzima importante no processo inflamatório, pois é a principal responsável pela hidrólise e pela degradação do monofosfato cíclico de adenosina (cAMP). O aumento na concentração do cAMP leva a uma diminuição na produção de citocinas pró-inflamatórias, como TNF-α , IL-23 e IFN -γ, além de propiciar aumento na produção de mediadores anti-inflamatórios, como o IL-10. De acordo com estudos[4,5], a inibição da PED4 pode modular diversas vias inflamatórias no corpo, uma vez que interrompe a cascata inflamatória no início, diferentemente de outros agentes biológicos, que atuam isoladamente em um único marcador pró-inflamatório, como o TNF-α.
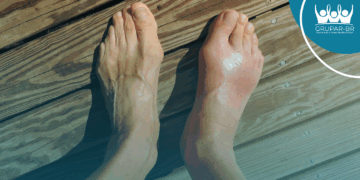
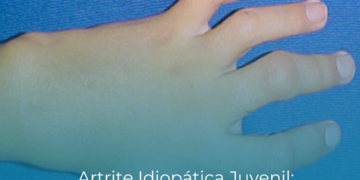
Os estudos que mostraram a eficácia do apremilaste para artrite psoriática, condição que atinge de 6% a 39% dos pacientes com psoríase, analisaram a eficácia e a segurança da molécula em 1493 pacientes divididos em três estudos de fase 3[6,7]. Os resultados, comparados com placebo, foram satisfatórios: o medicamento apresentou melhora clínica na artrite psoriática por até 52 semanas, incluindo sinais e sintomas, e função física[8].
O aprelimaste também se mostrou efetivo e foi aprovado para tratamento de psoríase em placas. Os estudos de fase 2 ESTEEM 1 e 2 com 1257 pacientes[9]mostraram que o medicamento reduz a gravidade da psoríase ungueal e do couro cabeludo.
A gravidade dos efeitos colaterais relatados nos estudos clínicos foi de leve a moderada. Cefaleia, diarreia, infecções no trato respiratório superior e náusea foram os eventos adversos mais comuns.
Aprovado para comercialização em comprimidos revestidos com concentração de 10 mg, 20 mg e 30 mg[1], Dr. Castro explica que o apremilaste também é considerado uma alternativa aos medicamentos tradicionais, mas que isso só será amplamente aceito caso o custo não seja mais alto do que o das medicações convencionais.
Fabricado pela farmacêutica Celgene, o apremilaste será comercializado com o nome de Otezla.
Incorporações
Até o momento não há informações sobre a incorporação dos medicamentos aprovados pela Agência Nacional de Saúde Suplementar (ANS) e pela Comissão Nacional de Incorporação de Tecnologias (CONITEC) no Sistema Único de Saúde (SUS). Pelo fato de a aprovação pela Anvisa ser recente, até o momento os preços dos medicamentos também não foram definidos pela Câmara de Regulação do Mercado de Medicamentos (CMED).
Referências
- Agência Nacional de Vigilância Sanitária. Anvisa. Notícias: Aprovados novos medicamentos para psoríase. Disponível em: http://portal.anvisa.gov.br/noticias
- Efficacy and safety of guselkumab, an anti-interleukin-23 monoclonal antibody, compared with adalimumab for the treatment of patients with moderate to severe psoriasis with randomized withdrawal and retreatment: Results from the phase III, double-blind, placebo- and active comparator–controlled VOYAGE 2 trial. Disponível em: http://www.jaad.org/article/S0190-9622(16)31158-6/abstract
- Guselkumab (Rx). Disponível em: https://reference.medscape.com/drug/tremfya-guselkumab-1000164
- Eric Ocheretyaner Tina Zerilli. Apremilast (Otezla): A New Oral Treatment for Adults With Psoriasis and Psoriatic Arthritis. PubMed Central (PMC). Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4517531/
- Efficacy and Safety Study of Apremilast to Treat Active Psoriatic Arthritis – Full Text View – ClinicalTrials.gov. Disponível em: https://clinicaltrials.gov/ct2/show/NCT01172938?term=PALACE%2C+Apremilast&rank=4
- PALACE 2: Efficacy and Safety Study of Apremilast to Treat Active Psoriatic Arthritis – Full Text View – ClinicalTrials.gov. Disponível em: https://clinicaltrials.gov/ct2/show/NCT01212757?term=PALACE%2C+Apremilast&rank=2
- PALACE 3: Efficacy and Safety Study of Apremilast to Treat Active Psoriatic Arthritis – Full Text View – ClinicalTrials.gov. Disponível em: https://clinicaltrials.gov/ct2/show/NCT01212770?term=PALACE%2C+Apremilast&rank=1
- A Phase III, Randomized, Controlled Trial of Apremilast in Patients with Psoriatic Arthritis: Results of the PALACE 2 Trial. – PubMed – NCBI. Disponível em: https://www.ncbi.nlm.nih.gov/pubmed/27422893
- Apremilast, an oral phosphodiesterase 4 inhibitor, in patients with difficult-to-treat nail and scalp psoriasis: Results of 2 phase III randomized,… – PubMed – NCBI. Disponível em: https://www.ncbi.nlm.nih.gov/pubmed/26549249
Fonte: https://portugues.medscape.com/verartigo/6502234#vp_2